2026年1月3日(周六),应中国药物依赖性研究所邀请,哈佛大学王云鹤博士作题为“Organ-specific proteomic aging clocks predict disease and longevity across diverse populations”的学术报告。报告由刘晓星博士主持。
王云鹤博士详细阐述了其研究团队如何利用机器学习技术,对英国生物样本库(UKB; n=43,616)的大规模蛋白质组学数据进行深度分析,成功开发出涵盖全身及十大特定器官系统的蛋白质组衰老时钟,并在中国生物样本库(CKB; n=3,977)及美国护士健康研究(NHS; n=800)队列中完成了严格的外部验证。研究结果证实,该套蛋白组衰老时钟在中国、英国、美国三大跨种族人群队列中均表现出高度的预测准确性,能够精准评估多种疾病的发生风险及全因死亡率(Wang et al., Nat Aging 2025)。
器官衰老时钟可精准评估器官的生物学年龄,报告人分析了不同器官衰老的异质性,发现各器官特异性生物学年龄差异之间的相关性较弱(平均相关系数约为0.16),且全身衰老时钟与各器官衰老时钟之间与年龄相关的蛋白质重叠度较低。这些结果提示,单一的整体衰老时钟会忽略大量器官特异性的衰老差异,因而难以有效刻画衰老的发生与发展过程。
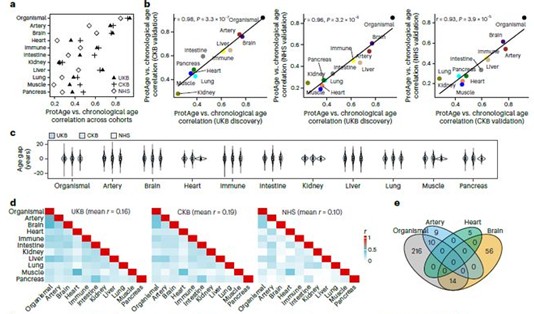
图一: 蛋白质组衰老时钟与不同人群疾病和死亡率的关系
报告人进一步对神经退行性疾病、精神疾病、全因死亡及常见慢性疾病的关联分析显示,器官衰老与疾病及死亡风险密切相关,其中大脑衰老扮演着核心角色。大脑衰老不仅最能预测全因死亡风险,还与神经退行性疾病及多种躯体疾病的风险呈显著相关。较大的“脑龄差”不仅可预测个体从健康状态向轻度认知障碍的转化,还能进一步预测其向典型神经退行性疾病的病理进展。同时,脑龄差与已知生物标志物存在交互作用,提示大脑衰老可作为大脑相关疾病的有效预测指标。。
报告人还进一步确定了与衰老及疾病相关的关键蛋白质,并解析其参与的生物学通路。这些与大脑衰老时钟密切相关的蛋白质在神经元和胶质细胞中高度富集,主要涉及突触信号传递与轴突发育,且同时与大脑衰老及神经退行性疾病相关。进一步分析提示,躯体蛋白是影响大脑衰老与神经退行性疾病进展的重要因素,表明器官特异性蛋白质组衰老时钟可作为追踪分子衰老、监测健康状态的生物学依据。在临床转化方面,报告人开发了简化版模型,仅需10种血浆蛋白即可构建“大脑时钟”,20种蛋白即可构建“整体时钟”,展现出良好的临床应用潜力。
总之,这项研究通过开发和验证基于蛋白质组学的衰老时钟,为理解衰老过程、预测疾病风险和开发抗衰老干预措施提供了新的视角和工具。
问答环节
Q1:既往研究多运用甲基化时钟预测衰老,本研究提出的“蛋白质组衰老时钟”与其相比有何优势?二者是否进行过效果比较?
王云鹤博士:目前衰老量化领域尚无统一的“金标准”,因为衰老是一个涉及多重生物学过程的复杂现象,单一维度的生物标志物(如仅靠甲基化或仅靠蛋白)难以全面预测。本研究未直接与甲基化时钟进行效果比较,但对比了一些传统标志物,发现器官特异性衰老时钟与其关联性较低。这提示不同维度的组学数据反映了衰老的不同侧面。目前学界正致力于多组学数据的整合分析,但受限于缺乏同时具备多维度组学结果的大型数据库,这一方向仍面临挑战。
Q2:本研究通过RNA特异性将血液蛋白匹配到不同器官,这种方法的特异性如何验证?是否存在局限?
王云鹤博士:这确实是目前研究的一个局限性。本研究采用了“4倍表达差异”作为界定器官特异性的标准,这也是目前该领域大多数研究所采用的主流标准。当然,该值可以根据具体研究需求进行调整,但目前缺乏更直接的手段对血液蛋白的器官来源特异性进行绝对验证。
Q3:优化后筛选出的10个器官特异性蛋白(特别是大脑相关蛋白),其功能机制是否明确?是否有动物实验证据支持?
王云鹤博士:既往文献表明,筛选出的这些蛋白大多与大脑功能密切相关,例如GFAP(胶质纤维酸性蛋白)已知与胶质细胞功能及损伤有关。部分蛋白已有一定的生物学证据支持,还有少部分被发现与神经遗传疾病相关。然而,针对这些蛋白在衰老具体机制中的因果作用,目前确实还缺乏系统的动物实验证据,这也是后续研究的重要方向。
Q4:既往已有基于影像学预测“脑龄”的研究,后续是否考虑结合“脑龄差”、器官特异性蛋白以及其他组学(如肠道菌群)进行多模态研究?
王云鹤博士:这是一个非常有价值的建议。既往的影像学模型主要局限于预测大脑年龄,难以覆盖全身器官。而本研究的优势在于利用蛋白数据实现了对全身多个器官年龄的预测。最近UKB数据库也释放了更多器官(如肝脏MRI噪声数据预测肝脏年龄)的影像数据。未来完全可以将蛋白组学、影像组学甚至肠道菌群等多模态数据结合起来,更全面、立体地解析衰老问题。
Q5:如果在建模中存在残差(即预测年龄与实际年龄不符),如何解释其生物学意义?是否可以用单维度指标刻画整体衰老?
王云鹤博士:建模中的残差(即“年龄差”)恰恰是本研究的核心生物学意义所在。衰老过程反映了突变和损伤的积累,模型预测越准(即相关性越强)并不一定代表越好,偏离模型反而可能反映了加速或延缓衰老的病理生理状态(例如,蛋白预测肾脏衰老的效果虽不如大脑精准,但其残差仍具有生物学意义)。目前尚无单一维度的完美指标能刻画整体衰老。本研究提出可以将这10个关键的器官特异性蛋白作为降维后的检测指标。我们的目标并非单纯预测疾病(已有许多成熟模型),而是通过模型揭示衰老的进程及疾病背后的机制。未来应尝试从更高维度对数据进行解析。
Q6:本研究涉及三个不同的人群数据库(UKB, CKB, NHS),如何处理数据库间的异质性?遗传因素与后天环境(如疾病、生活方式)如何影响器官衰老速度?
王云鹤博士:关于数据库一致性,我们并未将不同数据库的数据简单混合。模型是在UKB中进行训练和测试,然后将参数投射到CKB和NHS中进行验证。结果显示出很强的一致性,证明了模型的跨人群普适性。关于遗传与调控,GWAS分析显示,尽管大脑富集蛋白在大脑中高表达,但其基因调控往往是全身性的。这表明大脑衰老虽由特异性蛋白构建,但受全身生物学过程调控。关于疾病与环境影响,不同器官衰老确实受疾病影响(如慢性肾病加速衰老),但我们的敏感性分析显示,排除基线疾病患者后,结果依然稳健,说明疾病虽影响衰老但非决定性因素。此外,生活方式(睡眠、吸烟、饮酒等)与衰老速度显著相关,健康的生活方式评分越高,衰老速度越慢。
Q7:既然分别构建了全身和器官时钟,为何结果显示全身衰老时钟与器官时钟关联较低?
王云鹤博士:本研究检测了约3000种蛋白,通过对比发现,全身衰老时钟并非各器官衰老时钟的简单相加。全身时钟主要由大脑和血管的衰老特征驱动,而忽略了许多其他器官的特异性衰老轨迹。这也正是我们强调构建“器官特异性时钟”的必要性所在——它可以捕捉单一整体时钟无法反映的异质性信息。
Q8:器官特异性蛋白与相应器官疾病的对应关系是否明确?
王云鹤博士:关系非常明确。在模型训练中,我们只利用了蛋白的来源信息,但结果显示:神经退行性疾病主要与大脑特异性蛋白相关,而与其他器官(如肾脏)蛋白的相关性较差。这反向验证了器官特异性蛋白在预测特定器官疾病风险方面的特异性和有效性。
Q9:衰老研究在性别差异、动物模型结合方面有哪些展望?
王云鹤博士:关于性别差异,我们在建模过程中对性别进行了分层分析,发现衰老轨迹在男女间是类似的,因此最终模型整合了性别因素。关于动物模型与进化,虽然人类样本量目前有限,但未来可以将这10个关键蛋白在动物模型中进行机制验证。尽管不同物种寿命不同,但衰老的生物学过程在进化上可能具有保守性,这为从进化角度理解衰老提供了可能。
参考文献
撰文:宇文婷